При проведении реакции при постоянной температуре (isothermal进程) степень превращения реагентов зависит от их концентрации и не зависит от температуры, поэтому уравнение материального баланса можно проинтегрировать и получить зависимость степени превращения от времени.
При неизотермическом проведении процесса (адиабатическом или программно регулируемом) приходится решать совместно уравнения материального и теплового баланса с учетом зависимости скорости реакции от температуры и, 如果必要的话, процесса теплопередачи.
Для создания приблизительно изотермических условий в реакторе можно применить несколько способов теплообмена:
- теплообмен при постоянной скорости теплопередачи; когда реактор обогревается топочными газами или пламенем, коэффициент теплопередачи изменяется мало, а температура настолько высока, что изменение температуры реагентов практически не влияет на температурный напор;
- теплообмен при постоянном коэффициенте теплопередачи; 例如, в аппаратах с мешалкой коэффициент теплопередачи зависит в основном от скорости перемешивания, которую можно держать постоянной, и скорость теплопередачи будет определяться изменением температуры реагентов;
- автоматическое регулирование скорости теплопередачи путем регулирования расхода теплоносителя или изменения температуры его фазового перехода, например за счет давления.
Последний способ, в принципе, является самым лучшим, но не всегда экономически целесообразным.
Теплообмен в реакторах смешения. Рассмотрим химическую реакцию
A+B=R+ΔHr,
哪里 ΔHr – энтальпия реакции, J/mol.
Запишем уравнение теплового баланса, относя мольные энтальпии к некоторой температуре T与, 例如 0 º与, являющейся уровнем отсчета.
Начальная температура реагентов T0, конечная – T:
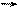
Q – количество отводимого или подводимого тепла, J.
Если отсутствуют фазовые превращения, то энтальпии компонентов можно выразить через теплоемкости:
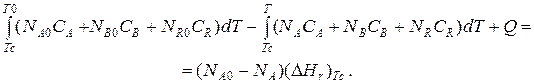
Если полагать, что теплоемкости не зависят от температуры в исследуемом интервале температур, а температура T0 является уровнем отсчета, то уравнение упростится:
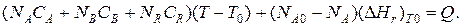
Зная состав исходной смеси, можно связать степень превращения и температуру. Для стехиометрической смеси, разделив последнее уравнение на NA0, 去:
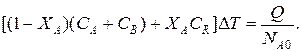
После преобразований
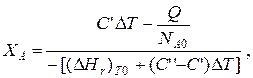
哪里 与’ 和 与’‘ – сумма теплоемкостей реагентов и продуктов реакции соответственно. 但, 如
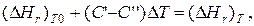
那
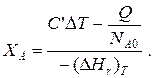
Здесь у энтальпии реакции и теплоты термодинамическое правило знаков,
t. e. тепло, подводимое к системе, считается положительным.
Для адиабатических условий Q=0, 所以
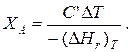
例 9.4. Для реакции первого порядка А+В=R, протекающей в адиабатических условиях, известны следующие данные: T0=28 º与; NA0=NB0=1 кмоль; NR0=0; 与和=在=125 Дж/(mol·去); CR=167 Дж/(mol·去);
H= -11600 J/mol. Константа скорости реакции в узком интервале температур зависит линейно от температуры
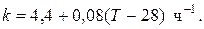
Определить степень превращения реагентов и время ее достижения, если температура в реакторе повысилась за счет реакции на 28 去?
解决办法: Полагая отсутствие фазовых превращений в процессе, составим уравнение теплового баланса
[(1-XA)(125+125)+167XA](T - 28)-11600XA=0;
(250-83XA)(T-28)=11600XA;
T-28=28=11600XA/(250-83XA);
XA=0,503.
Определим время реакции из баланса массы при условии реакции первого порядка
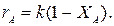
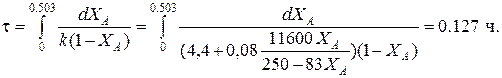
(Последний интеграл вычислен численным методом по формуле Симпсона.)
Составим тепловой баланс в дифференциальной форме, полагая, что за элементарное время dt скорость реакции rA и скорость теплопередачи R определяются уравнениями
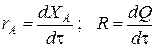 ;
;
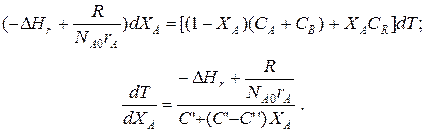
Теплоемкость и скорость реакции являются известными функциями температуры. Если скорость теплопередачи задана в функции от температуры, то последнее уравнение можно проинтегрировать. Для трех рассмотренных способов теплообмена связь между температурой и скоростью теплопередачи имеет вид:
- теплообмен при постоянной скорости теплопередачи
R=const;
- теплообмен при постоянном коэффициенте теплопередачи
R=KS(Tt-T), KS=const, Tt=const;
- автоматическое регулирование скорости теплопередачи
R=DHr·rA=KS(Tt-T), T=const.
这里的: K – коэффициент теплопередачи, 瓦特 /(m2*去);
S – поверхность теплопередачи, m2;
Tt – температура теплоносителя.
例 9.5. Для реакции первого порядка известны следующие данные: энтальпия реакции DHr=11600J/mol; константа скорости реакции k=0,8 ч-1; коэффициент теплопередачи 去=51 Вт/(m2·去); начальная загрузка реагента NA0=2270 моль. Определить поверхность теплообмена, необходимую для поддержания постоянной температуры t=49 ºС до конечной степени превращения XA=70 %. Нагрев осуществляется паром, температуру которого Tt можно регулировать в пределах от 110 去 177 º与.
解决办法: Скорость подвода тепла должна быть наибольшей в начале процесса, 的时候 X和=0, а скорость реакции – наибольшая. Расчет будем производить, 使用的方程式
DHr·rA=KS1(Tt-T).
Откуда максимальная поверхность теплопередачи в этот момент выразится уравнением
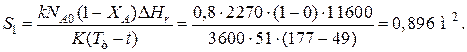
При такой поверхности и конечной степени превращения X和=0.7 температура теплоносителя должна быть равна
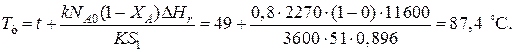
Эту температуру не обеспечить паром заданных параметров. 程度的转变, отвечающая наиболее низкой заданной температуре теплоносителя 110 º与, при поверхности теплопередачи S1 составит
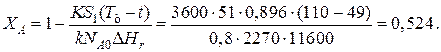
При температуре теплоносителя 110 ºС и степени превращения 0,7 已
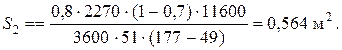
的时候 X和=0.524 и S2=0.564 м2 已
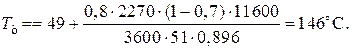
因此,, нагреватель должен состоять из двух параллельных змеевиков, один из которых с поверхностью S1=0,564 м2, а другой –
S2=0,896-0,564=0,332 м2. При снижении температуры пара до 110 ºС змеевик с поверхностью 0,332 m2 следует отключить.
Кривые регулирования строятся по уравнениям

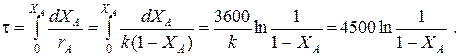
的时候 X和£0.52 TT=49+128(1-X和);
的时候 X和>0.52 TT=49+203(1-X和).
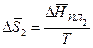
|
| 米. 9.2. К расчету теплообмена в реакторе вытеснения |
Теплообмен в реакторах вытеснения. Если полагать отсутствие в реакционной зоне реактора идеального вытеснения радиальных градиентов температур, то можно составить три уравнения, одно из которых – баланс массы, второе – баланс тепла по реакционной массе и третье – баланс тепла по теплоносителю. Схема тепло- и массообмена в элементе реактора представлена на рис. 9.2.
Уравнение баланса массы
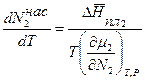
Уравнение баланса тепла в элементе реакционной зоны
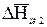
Уравнение баланса тепла в элементе рубашки
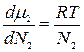
Совместное решение системы из трех дифференциальных уравнений дает возможность определить распределение степеней превращения, температур реакционной смеси и теплоносителя по длине реактора идеального вытеснения.
Для адиабатического реактора идеального вытеснения получаем систему из двух дифференциальных уравнений
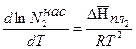
例 9.6. В гомогенном реакторе идеального вытеснения, представляющем собой трубу внутренним диаметром 50мм, протекает адиабатическая реакция второго порядка. Кинетические параметры реакции: энергия активации E=58200 Дж/моль, k0= 2·107 m3/(mol·h). Начальная концентрация реагента 20 KMOL/m3, его мольный расход 60 各种工业过程/h, теплоемкость реакционной смеси 125 J/(mol·去). Энтальпия реакции
DHr=-10000 J/mol. Определить длину реактора при 90 %-ной степени превращения, если начальная температура реагентов 77 º与.
解决办法: Подставим исходные данные в систему дифференциальных уравнений материального и теплового баланса адиабатического реактора:
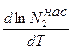
После преобразований получим:
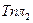
表 9.6.Результаты решения дифференциального уравнения
| z, m | 0,0 | 0,2 | 0,4 | 0,6 | 0,8 | 1,0 | 1,2 | 1,3 |
| XA, % | 0,00 | 12,94 | 30,31 | 51,50 | 70,54 | 82,22 | 88,32 | 90,21 |
| T, K | 350,0 | 360,4 | 372,2 | 391,2 | 406,4 | 415,8 | 420,7 | 422,2 |
Решая полученную систему численным методом, можем найти длину реактора. 例如, при решении модифицированным методом Эйлера при шаге интегрирования 0.02 м получаем длину реактора 1,3 m (cm.
表. 9.6).






