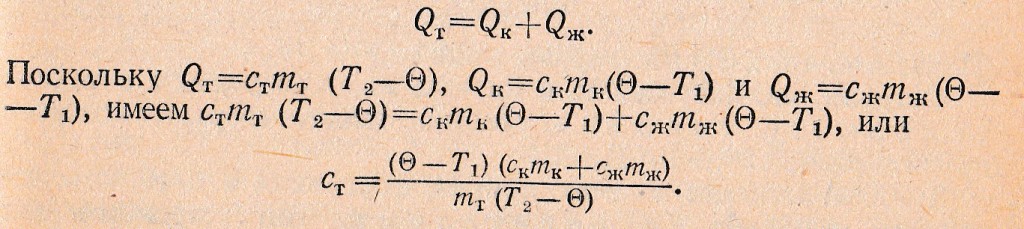تذكر, في غياب الأعمال الميكانيكية تغير الطاقة الداخلية في الجسم لتقدير كمية الحرارة Q. منذ محض نقل الحرارة أي أنواع أخرى من التغيرات في الطاقة الداخلية ليست, على أساس قانون الحفاظ على الطاقة يمكن القول, في هذه الحالة كم من الدفء سوف تعطي بعض الجسم, نفس المكاسب الأخرى. على هذا الأساس تجميع معادلة التوازن الحراري, الأمر الذي جعل جميع الحسابات.
لذا, عندما تبادل الحرارة كمية الحرارة المبلغ, بالنظر إلى جميع الهيئات, الطاقة الداخلية يقلل من, يساوي مجموع كميات الحرارة, جميع الهيئات, الطاقة الداخلية يزيد:
نقل الحرارة يحدث حتى, في حين أن درجة حرارة الهيئات غير متساوية. العام في درجة الحرارة, التي يتم الحصول عليها بعد تبادل الحرارة, لتدل على Ɵ (اليونانية. ثيتا).
مثلا معادلة التوازن الحراري, والتي تستخدم في تحديد السعة الحرارية لمادة باستخدام المسعر. تقريبا يمكن اعتبار, في هذه الحالة نقل الحرارة ينطوي على ثلاث هيئات: المسعر, السائل و الجسم, الحرارة النوعية للمواد التي تحدد. هذا الجسم هو يسخن إلى درجة حرارة معينة T2 وخفضت إلى المسعر مع السائل, درجة الحرارة T1. بعد بعض الوقت في المسعر يحدد مشترك النهائي درجة حرارة الهاتف Ɵ. يمكن القول, في عملية تبادل الحرارة الجسم أعطى كمية الحرارة QT, في حين المسعر و السائل على التوالي Qإلى و سث. لذا:
استبدال في الجانب الأيمن من الماضي صيغة قيم رقمية, المستمدة من التجربة, حساب الحرارة النوعية للمادة الجسم.